C7H6O3(s)+C4H6O3(l) → C9H8O4(s)+C2H4O2(l) จงหา
ก. มวลของแอซีติกแอนไฮไดรด์ที่ต้องใช้ในการทำปฎิกิริยาพอดีกับกรดซาลิซิลิกจำนวน 5.00x10ยกกำลัง2 กรัม
ข. มวลของแอสไพรินที่เกิดขึ้นจากปฎิกิริยา
2. การผลิตกรดฟอสฟอริก (H3PO4)เพื่อการค้าจะใช้ทำปฎิกิริยากันดังสมการ
Ca3(PO4)2(s)+3H2SO4(aq)+6H2O(l) → 3CaSO4•2H2O(s)+2H3PO4(aq)
จงคำนวณหามวลของกรดซัลฟิวริกเข้มข้น (H2SO4)ที่ต้องใช้ทำปฎิกิริยาพอดีกับแคลเซียมฟอสเฟต (Ca3(po4)2 )จำนวณ 100.0กรัม
3. จะต้องใช้อากาศกี่กรัม เพื่อเผาไหม้ถ่านหิน 120.0 กรัม โดยที่ถ่านหินประกอบด้วยคาร์บอน (C) ร้อยละ 95.0 และส่วนประกอบอื่นที่ไม่เกิดการเผาไหม้ร้อยละ 5.0 กำหนดให้อากาศมีแก๊สออกซิเจน (O2)เป็นองค์ประกอบร้อยละ 23.0 โดยมวลการคำนวณปริมาณสารจากสมการเคมี
การเกิดปฏิกิริยาเคมีเป็นไปได้หลายลักษณะ โดยอาจเป็นปฏิกิริยาที่เกิดขึ้นเพียงขั้นตอนเดียว หรือหลายขั้นตอน บางครั้งเกิดขึ้นอย่างสมบูรณ์ บางครั้งเกิดไม่สมบูรณ์
นอกจากนั้นยังต้องคำนึงถึงผลได้ของปฏิกิริยาด้วย การคำนวณปริมาณสารจากสมการเคมีมีความสำคัญอย่างยิ่งทั้งต่อการเรียนรู้เคมีในขั้นต่อไปและในธุรกิจอุตสาหกรรมเคมี
รูปแบบของการเกิดปฏิกิริยาที่พบได้มากมี 4 ลักษณะ ดังนี้
นอกจากนั้นยังต้องคำนึงถึงผลได้ของปฏิกิริยาด้วย การคำนวณปริมาณสารจากสมการเคมีมีความสำคัญอย่างยิ่งทั้งต่อการเรียนรู้เคมีในขั้นต่อไปและในธุรกิจอุตสาหกรรมเคมี
รูปแบบของการเกิดปฏิกิริยาที่พบได้มากมี 4 ลักษณะ ดังนี้
- ปฏิกิริยาขั้นตอนเดียวที่เกิดขึ้นอย่างสมบูรณ์
- ปฏิกิริยาขั้นตอนเดียวแต่เกิดขึ้นไม่สมบูรณ์
- ปฏิกิริยามากกว่า 1 ปฏิกิริยาแต่เกิดขึ้นอย่างอิสระ
- ปฏิกิริยามากกว่า 1 ปฏิกิริยาแบบต่อเนื่องกัน
ปฏิกิริยาขั้นตอนเดียวที่เกิดขึ้นอย่างสมบูรณ์
ปฏิกิริยาลักษณะนี้จะประกอบด้วยสมการเคมีเพียง 1 สมการ โดยมีสารตั้งต้นทุกชนิดอยู่ในปริมาณที่ทำปฏิกิริยากันได้พอดี คือเมื่อปฏิกิริยาสิ้นสุดแล้ว
จะไม่มีสารตั้งต้นชนิดใดเหลืออยู่เลย สารตั้งต้นทั้งหมดเปลี่ยนไปเป็นผลิตภัณฑ์ เช่น 2H2(s) + O2(g) → 2H2O(g) เมื่อปฏิกิริยาเกิดขึ้นอย่างสมบูรณ์
ความสัมพันธ์ของประมาณสารต่าง ๆ ในปฏิกิริยาเป็นดังนี้
จะไม่มีสารตั้งต้นชนิดใดเหลืออยู่เลย สารตั้งต้นทั้งหมดเปลี่ยนไปเป็นผลิตภัณฑ์ เช่น 2H2(s) + O2(g) → 2H2O(g) เมื่อปฏิกิริยาเกิดขึ้นอย่างสมบูรณ์
ความสัมพันธ์ของประมาณสารต่าง ๆ ในปฏิกิริยาเป็นดังนี้
2H2(s)
|
+
|
O2(g)
|
→
|
2H2O(g)
| |
จำนวนโมล
|
2
|
+
|
1
|
→
|
2
|
อัตราส่วนโดยจำนวนโมลระหว่าง H2 : O2 : H2O = 2 : 1 : 2
| |||||
จำนวนโมเลกุล
|
2 x 6.02 x 1023
|
+
|
6.02 x 1023
|
2 x 6.02 x 1023
| |
อัตราส่วนโดยจำนวนโมเลกุลระหว่าง H2 : O2 : H2O = 2 : 1 : 2
| |||||
มวล (กรัม)
|
4 g
|
+
|
32 g
|
→
|
36 g
|
อัตราส่วนโดยมวล (กฎสัดส่วนคงที่)ระหว่าง H2 : O2 : H2O = 1 : 8 : 9
| |||||
ปริมาตรที่ STP
(dm3)
|
2 x 22.4 dm3
44.8 dm3
|
+
|
22.4 dm3
22.4 dm3
|
→
|
2 x 22.4 dm3
44.8 dm3
|
อัตราส่วนโดยปริมาตรที่ STP ระหว่าง H2 : O2 : H2O = 2 :1 : 2
| |||||
ความหมายของสมการเคมี
สมการเคมีต่าง ๆ จะบอกให้เราทราบความสัมพันธ์ระหว่างปริมาณสารต่าง ๆ ในปฏิกิริยานั้น ๆ จากปฎิกิริยาดังตัวอย่าง 2H2(s) + O2(g) → 2H2O(g)
เราสามารถกล่าวถึงความสัมพันธ์ระหว่างปริมาณสารต่าง ๆ ได้หลายลักษณะ ดังนี้
เราสามารถกล่าวถึงความสัมพันธ์ระหว่างปริมาณสารต่าง ๆ ได้หลายลักษณะ ดังนี้
- ก๊าซ H2 จำนวน 2 โมล ทำปฏิกิริยาพอดีกับก๊าซ O2 จำนวน 1 โมล
- จำนวนโมลของก๊าซ H2 ที่ใช้ในการทำปฏิกิริยานี้จะเป็น 2 เท่าของจำนวนโมลของก๊าซ O2 เสมอ ไม่ว่าจะใช้ในปริมาณมากหรือน้อยเท่าไร
- จำนวนโมลของก๊าซ O2ที่ใช้จะเป็นครึ่งหนึ่งของ H2 เสมอ ไม่ว่าจะใช้ปริมาณมากหรือน้อยเท่าไร
- ถ้าคิดเป็นน้ำหนัก ก็จะใช้ H2 จำนวน 4 กรัม ทำปฏิกิริยาพอดีกับ O2 หนัก 32 กรัม หรือคิดเป็นอัตราส่วน 1 : 8 เสมอ
- หรือกล่าวว่าน้ำหนักของ H ที่ใช้ = ของน้ำหนักของ O2
- หรือกล่าวว่าน้ำหนักของ O2 ที่ใช้จะเป็น 8 เท่าของน้ำหนัก H2 เสมอ
- ถ้าคิดเป็นจำนวนโมเลกุล ก็จะใช้ H2 จำนวน 2x6.02x1023 โมเลกุล ในการทำปฏิกิริยาพอดีกับ O2 จำนวน 6.02 x 1023 โมเลกุล
- ถ้าคิดเป็นปริมาตรของก๊าซที่ STP ก็จะใช้ H2 ปริมาตร 2x22.4 dm3 ทำปฏิกิริยาพอดีกับ O2 จำนวน 22.4 dm3
- ถ้าใช้ H2 จำนวน 2 โมล จะได้ H2O จำนวน 2 โมล
- จำนวนโมลของ H2 ที่ใช้จะ เท่ากับจำนวนโมลของ H2O ที่ได้
- ใช้ H2 จำนวน 4 กรัม จะได้ H2O จำนวน 36 กรัม
- ถ้าใช้ O2 จำนวน 1 โมล จะได้ H2O จำนวน 2 โมล
- จำนวนโมลของน้ำที่ได้จะเป็น 2 เท่าของจำนวนโมลของ O2 ที่ใช้
- จำนวนโมลของ O2 ที่ใช้จะเป็นครึ่งหนึ่งของจำนวนโมลของน้ำที่ได้
- อื่น ๆ .....
***ปริมาณสารที่ใช้ในปฏิกิริยาต่าง ๆ จะใช้มากขึ้นหรือน้อยลงกว่าจำนวนโมลที่แสดงอยู่ในสมการเคมีก็ได้ แต่เมื่อเพิ่มหรือลดปริมาณของสารใด สารอื่น ๆ
ก็จะเพิ่มขึ้นหรือลดลงเป็นอัตราส่วนตามจำนวนโมลของแต่ละสารที่แสดงอยู่ในสมการเคมีนั้น ๆ ที่ดุลแล้ว เนื่องจากการเกิดปฏิกิริยาย่อมเป็นไปตามกฎสัดส่วนคงที่
ก็จะเพิ่มขึ้นหรือลดลงเป็นอัตราส่วนตามจำนวนโมลของแต่ละสารที่แสดงอยู่ในสมการเคมีนั้น ๆ ที่ดุลแล้ว เนื่องจากการเกิดปฏิกิริยาย่อมเป็นไปตามกฎสัดส่วนคงที่
ตัวอย่าง จากสมการเคมี Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) จะต้องใช้ Zn หนักกี่กรัม ในการเตรียม แก๊ส H2 จำนวน 6.9 dm3 ที่ STP (Zn = 65)
1. 13.3 2. 14.5 3. 18.6 4. 19.5
วิธีทำ ก่อนอื่นต้องติจารณาให้เข้าใจก่อนว่าโจทย์ต้องการทราบสิ่งใด และโจทย์กำหนดสิ่งใดมาให้ ในที่นี้โจทย์ต้องการทราบน้ำหนักของ Zn ว่าจะต้องใช้กี่กรัม โดยกำหนดปริมาตร
H2 ที่ต้องการที่ STP มาให้ กลับไปดูที่สมการเคมีจะเห็นความสัมพันธ์ระหว่างสิ่งที่โจทย์ต้องการทราบกับสิ่งที่โจทย์กำหนดมาให้ ดังนี้
H2 ที่ต้องการที่ STP มาให้ กลับไปดูที่สมการเคมีจะเห็นความสัมพันธ์ระหว่างสิ่งที่โจทย์ต้องการทราบกับสิ่งที่โจทย์กำหนดมาให้ ดังนี้
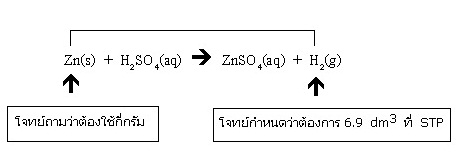
พิจารณาจากสมการเคมีก็จะเห็นว่าสิ่งที่โจทย์กำหนดกับสิ่งที่โจทย์ถามมีจำนวนโมลเท่ากัน การคิดคำนวณควรเริ่มจากเปลี่ยนปริมาตร H2 ที่โจทย์กำหนดมาให้ให้เป็นจำนวนโมล
ได้เท่าไรก็หมายความว่า Zn ที่จะต้องใช้ก็มีจำนวนโมลเท่ากัน แล้วเปลี่ยนจำนวนโมลของ Zn ให้เป็นกรัมก็จะได้คำตอบ
ได้เท่าไรก็หมายความว่า Zn ที่จะต้องใช้ก็มีจำนวนโมลเท่ากัน แล้วเปลี่ยนจำนวนโมลของ Zn ให้เป็นกรัมก็จะได้คำตอบ
โจทย์กำหนดว่าต้องการ H2 จำนวน 6.9 dm3 ที่ STP ซึ่งคิดเป็นจำนวนโมล
ถ้า H2 มีปริมาตร 22.4 dm3 ที่ STP มีจำนวนโมล = 1 โมล
ถ้า H2 มีปริมาตร 6.9 dm3 ที่ STP มีจำนวนโมล = 1 x 6.9 / 22.4 โมล
= 0.30 โมล
ถ้า H2 มีปริมาตร 6.9 dm3 ที่ STP มีจำนวนโมล = 1 x 6.9 / 22.4 โมล
= 0.30 โมล
จากสมการ จำนวนโมลของ Zn ที่ใช้ = จำนวนโมลของ H2 ที่ได้
เพราะฉะนั้นจะต้องใช้จำนวนโมลของ Zn = 0.3 โมล
คิดเป็นน้ำหนักของ Zn ดังนี้
ถ้ามี Zn จำนวน 1 โมล จะมีน้ำหนัก = 65 กรัม
ถ้ามี Zn จำนวน 0.3 โมล จะมีน้ำหนัก = 65 x 0.3
= 19.5 กรัม ตอบ
ถ้ามี Zn จำนวน 0.3 โมล จะมีน้ำหนัก = 65 x 0.3
= 19.5 กรัม ตอบ
ใช้สูตร

